
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Bosutinib CAS 380843-75-4
2023-08-21
نام شیمیایی:
4-(2،4-دی کلرو-5-متوکسیانیلینو)-6-متوکسی-7-[3-(4-متیل پیپرازین-1-ایل) پروپوکسی]کینولین-3-کربونیتریل
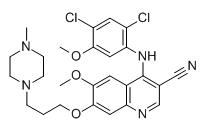
M.F:C26H29Cl2N5O3
خواص شیمیایی :زرد کم رنگ جامد
Bosutinib یک مهارکننده Bcr-Abl کیناز برای درمان لوسمی میلوژن مزمن کروموزوم فیلادلفیا (Ph+) است. در مقایسه با سایر مهارکننده های تیروزین کیناز، مشخصات سمیت خونی مطلوب تری دارد. FDA در 4 سپتامبر 2012 تایید شد.
مبتکر:Wyeth Pharmaceuticals (Pfizer) (ایالات متحده)
برنامه های کاربردی:
اثرات روی مورفولوژی سلولی در غلظت 1 میکرومولار SKI-606 برای همه ردههای سلولی مورد بررسی مشاهده شد و تغییرات مورفولوژیکی در غلظتهای کمتر از 0.25 میکرومولار آشکار شد. SKI-606 باعث شد که سلولها به یکدیگر بچسبند و در مقایسه با سلولهای تیمار شده با کنترل وسیله نقلیه (DMSO) خوشههای متراکمی را تشکیل دادند که نشان داد در مناطق بزرگتری پخش میشوند.
شکل مصرف: تجویز خوراکی، mg/kg/d 100، به مدت 28 روز
واسطه ها:
CAS شماره 2031-23-4 1-(3-کلروپروپیل)-4-متیل پیپرازین دی هیدروکلراید
شماره CAS 214470-66-3 7-(3-chloropropoxy)-4-hydroxy-6-methoxyquinoline-3-carbonitrile
شماره CAS 214470-68-5 4-CHLORO-7-(3-CHLORO-PROPOXY)-6-METHOXY-QUINOLINE-3-CARBONITRILE
شماره CAS 263149-10-6 4-CHLORO-7-HYDROXY-6-METHOXY-QUINOLINE-3-CARBONITRILE
CAS شماره.
داروی هدفمند Bsutinib (Bosulif) توسط سازمان غذا و دارو (FDA) برای درمان لوسمی میلوژن مزمن تایید شده است. Besutinib یک مهارکننده کیناز است که مسیرهای سیگنالینگ Abl و Src را مهار می کند. طبق اعلامیه انکولوژی فایزر، این دارو برای درمان بیماران بالغ CML کروموزوم مثبت فیلادلفیا مزمن، تسریع شده یا حاد (Ph+) با مقاومت قبلی یا عدم تحمل دارویی در نظر گرفته شده است. فایزر گفت حدود یک سوم بیماران CML به درمان با داروی استاندارد خط اول Gleevec پاسخ خوبی نمی دهند. این شرکت گفت، حدود نیمی از بیمارانی که مقاومت یا عدم تحمل به ایماتینیب دارند، به دیگر مهارکنندههای تیروزین کیناز خط دوم (TKI) نیز پاسخ ضعیفی میدهند.
تأیید داروی خوراکی اساساً بر اساس کارآزماییهای بالینی فاز I و فاز II است که شامل 500 بیمار CML با PH مثبت بود که به ایماتینیب پاسخ نمیدادند یا به ایماتینیب حساسیت نداشتند، از جمله گروههای مختلف در مراحل مزمن، تسریعشده و حاد. بر اساس دادههای کارآزمایی بالینی Pfizer، یک سوم بیمارانی که قبلاً با ایماتینیب به تنهایی درمان شدهاند، پس از 24 هفته مصرف Bosutinib (500 میلیگرم یک بار در روز) به بهبودی سیتوژنتیکی عمده دست یافتند. در بیمارانی که ایماتینیب و یک مهارکننده تیروزین کیناز دیگر (dasatinib، Sprycel) دریافت کردند، 27٪ به بهبودی سیتوژنتیک عمده دست یافتند. فایزر گفت که میزان پاسخ در هر دو گروه پس از 24 هفته یا بیشتر از دارو به افزایش ادامه داد. فایزر خاطرنشان می کند که تنها 4 درصد از بیماران مبتلا به بیماری مزمن پس از مصرف Besutinib به مرحله پیشرفته یا حاد پیشرفت می کنند. عوارض جانبی درجه 3-4 شامل ترومبوسیتوپنی (26%)، نوتروپنی (11%)، اسهال (9%)، کم خونی (9%) و بثورات پوستی (8%) است.
Bosutris (Bosutinib) bossutinib در اصل توسط Pfizer ساخته شد و برای اولین بار در سپتامبر 2012 در ایالات متحده برای استفاده در بزرگسالان مبتلا به Ph+CML که سابقه قبلی مقاومت یا عدم تحمل به درمان در مراحل مزمن، تسریع شده یا حاد داشته اند مورد تایید قرار گرفت. . BOSULIF اولین داروی فایزر برای درمان تومورهای خونی است و یک گزینه درمانی مهم برای بیماران Ph+CML با مقاومت دارویی یا عدم تحمل قبلی است. این نشانه گسترده این پتانسیل را دارد که تأثیر بیشتری بر زندگی بیماران مبتلا به لوسمی میلوژن مزمن داشته باشد.
در 13 ژوئیه 2020، شرکت دارویی Mylan هند راهاندازی تجاری Bosutinib (Bosutinib/Bosutinib/Bosutinib) ژنریک Bosutris را افتتاح کرد. یک نسخه عمومی از بوسوتریس Mylan حدود 25٪ کمتر از Bosulif اصلی فایزر قیمت دارد. (همچنین: Upjohn، بازوی ژنریک Pfizer، امسال با Mylan ادغام خواهد شد تا Viatris، بزرگترین شرکت ژنریک جهان را ایجاد کند، که در سه ماهه چهارم سال 2020 تکمیل خواهد شد.)




